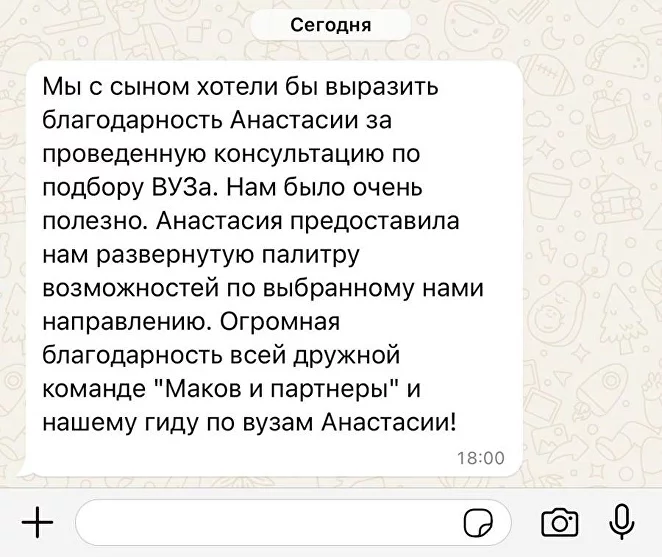
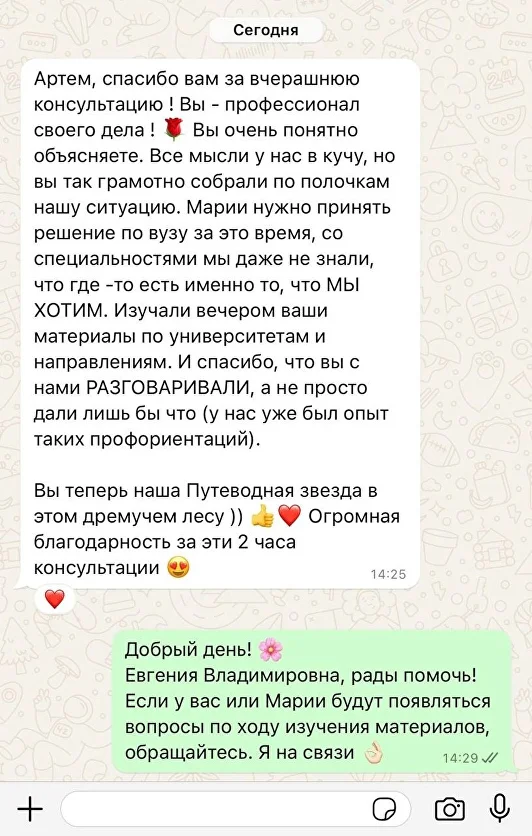
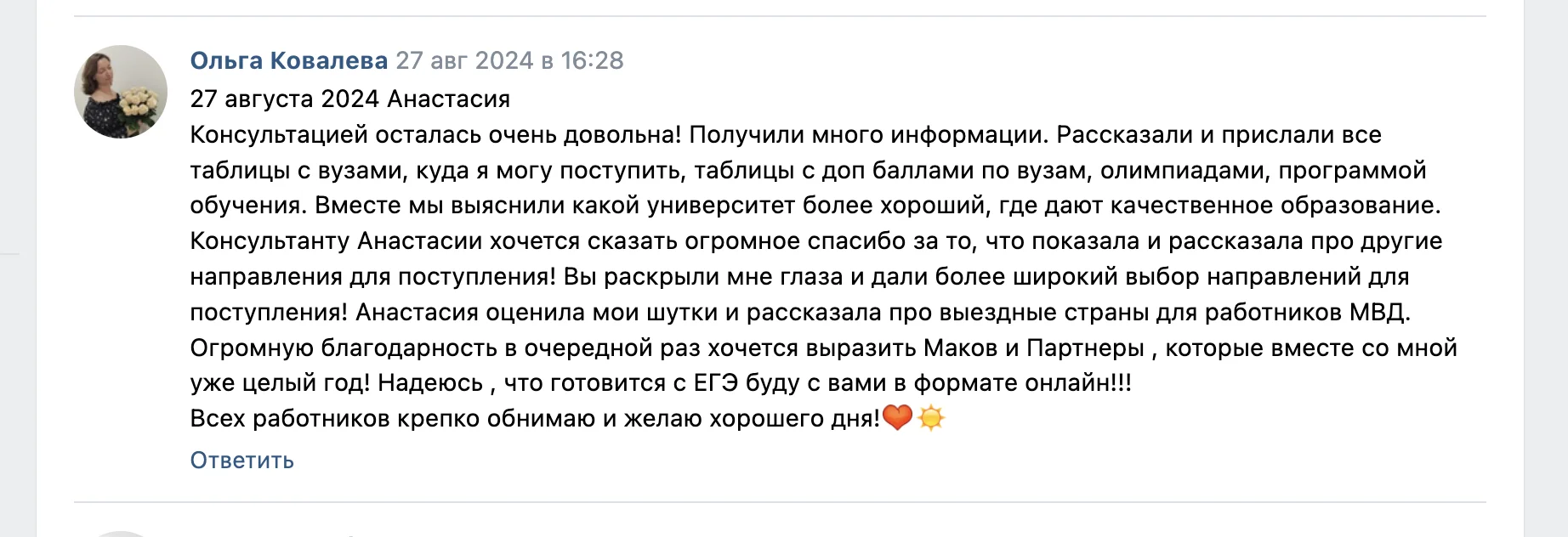
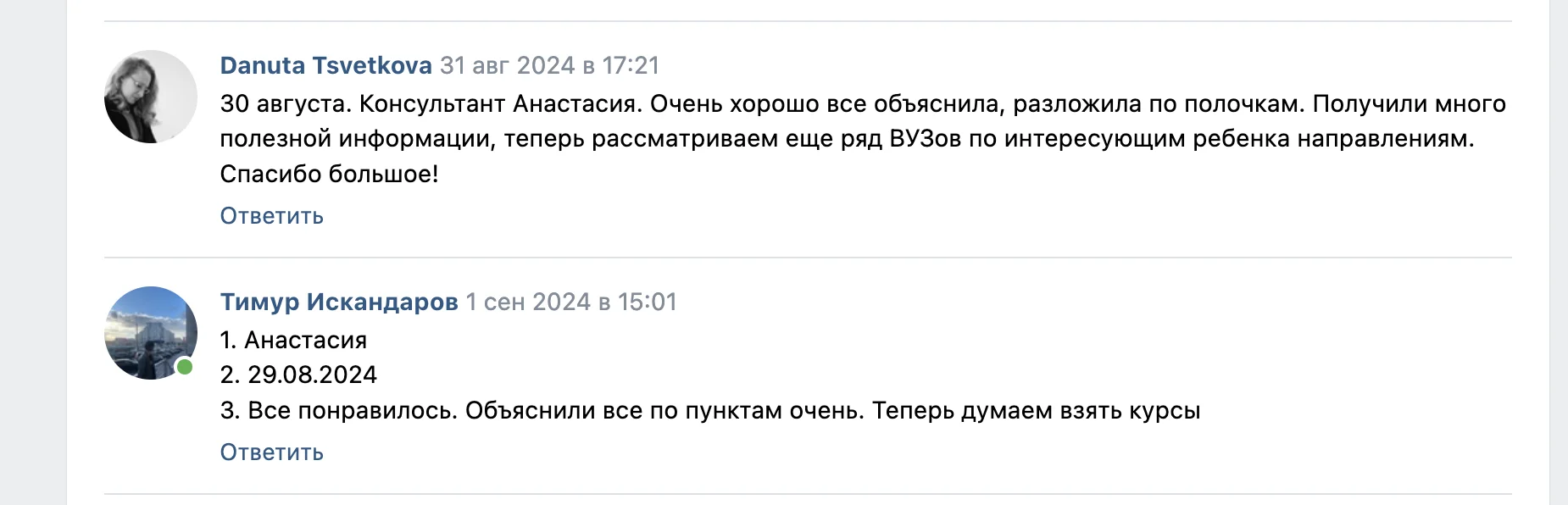
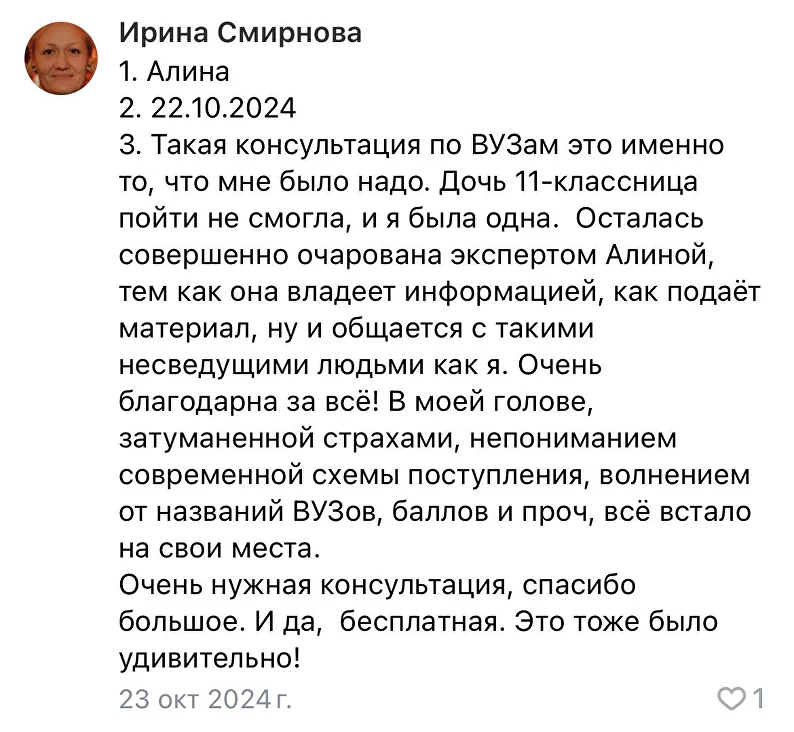
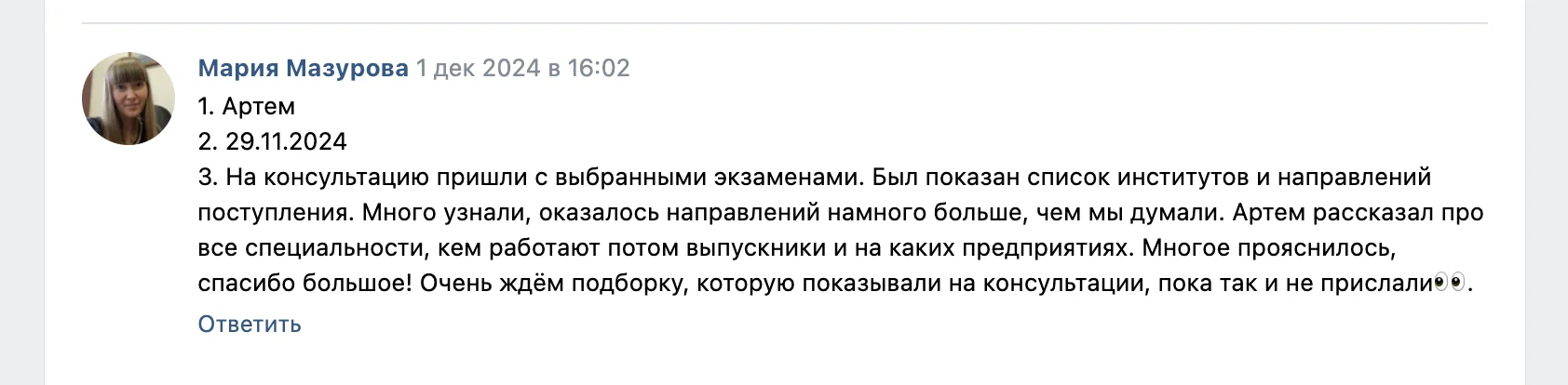
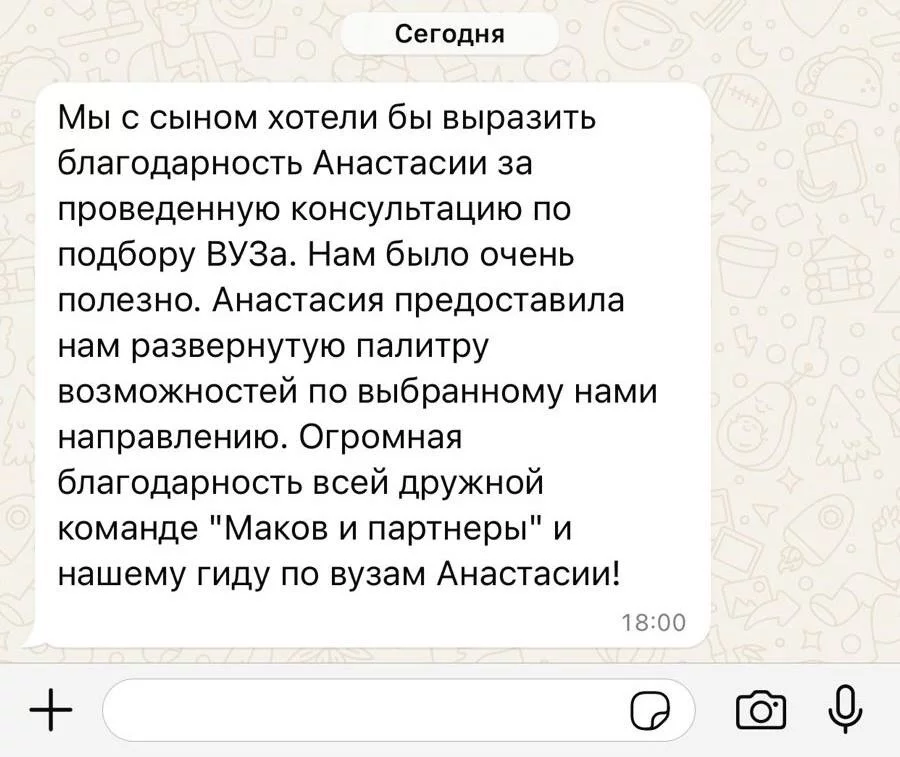
Привет)
Слышал когда-нибудь про такую штуку, как «пэ аш»? Ну или формулировку «кислая среда»? Или, скажем, «щелочной раствор»? Интересно разобраться, что это такое и как работает? Тогда скорей читать статью!
Давай для начала вспомним.
Был такой мудрый дядька Аррениус. И вот как-то он решил дать адекватную формулировку основаниям и кислотам.
Сказал как отрезал:
«Кислоты – это электролиты, при диссоциации которых в водных растворах образуются катионы водорода H+ (часто говорят «протоны»), а основания – это электролиты, при диссоциации которых в водных растворах образуются гидроксид-анионы OH–».
Сильное заявление.
С учётом того, что за него была присуждена Нобелевка (1903 г.) – то ещё и объективное.
А потом слово за слово дошли и до того, что вода-то, оказывается, тоже своего рода кислота. И основание. Ну то есть буквально:
H₂O ⇌ H++ OH–
Слышал когда-нибудь про такую штуку, как «пэ аш»? Ну или формулировку «кислая среда»? Или, скажем, «щелочной раствор»? Интересно разобраться, что это такое и как работает? Тогда скорей читать статью!
Давай для начала вспомним.
Был такой мудрый дядька Аррениус. И вот как-то он решил дать адекватную формулировку основаниям и кислотам.
Сказал как отрезал:
«Кислоты – это электролиты, при диссоциации которых в водных растворах образуются катионы водорода H+ (часто говорят «протоны»), а основания – это электролиты, при диссоциации которых в водных растворах образуются гидроксид-анионы OH–».
Сильное заявление.
С учётом того, что за него была присуждена Нобелевка (1903 г.) – то ещё и объективное.
А потом слово за слово дошли и до того, что вода-то, оказывается, тоже своего рода кислота. И основание. Ну то есть буквально:
H₂O ⇌ H++ OH–
Диссоциирует? Слабо, но да.
Значит, электролит? Слабый, но да.
Протоны раствору даёт? Значит, кислота.
А гидроксид-анионы? Значит, основание.
И ведь неслучайно это важно. В какой-то момент людям стало понятно, что для успешного культивирования растений, аккуратной медицины, да даже для изготовления новых материалов важна такая штука, как «среда раствора», в котором и происходит всё это действо.
Известно, что выделяют три типа среды раствора:
Очевидно, что в подкисленном растворе может наблюдаться избыток H+, а в щелочном растворе будет больше OH–. В нейтральном же и того, и другого одинаковое количество, и они то и дело объединяются обратно в воду.
То есть нейтральный раствор = водный.
Ну, допустим, всё понятно. Залил кислоту в раствор – и среда кислая. Чем сильнее кислота, тем более кислая среда. Растворил щёлочь – получил щелочную среду.
Но тогда, скажите на милость, каким образом при растворении нормальных, самых обычных солей меняется среда? Вот возьму, например, нитрит натрия NaNO2. Да, он электролит, и диссоциирует по следующей схеме:
NaNO2 ⇌ Na+ + NO2–
Ни тебе протонов, ни гидроксид-анионов. Макаю индикаторную бумажку – а она окрашивается так, будто среда щелочная. КАК?!
Спокойно, сейчас разберёмся.
Для начала вспомним, что соли всегда соответствуют каким-то кислотам и основаниям. Наш нитрит натрия – это продукт гидроксида натрия, от которого взят катион, и азотистой кислоты, от которой взят анион.
Вся фишка в том, что азотистая кислота сама по себе – слабая. То есть оказываясь в растворе, она диссоциирует (распадается) обратимо! Одновременно идёт и распад одних молекул, и образование новых.
HNO2 ⇌ H+ + NO2–
Но кто мне мешает переписать это уравнение задом наперёд? Смысл от этого не меняется.
H+ + NO2– ⇌ HNO2
Уже догадались, к чему я клоню?)0)
Мы бросили в раствор соль нитрит натрия. В воде всегда есть небольшое количество и катионов водорода H+, и гидроксид-анионов OH–. Фишка в том, что как только соль распалась на ионы, эти самые нитрит-анионы NO2– сразу же стали забирать H+. Ведь они соответствуют слабой кислоте HNO2.
А OH– никто не трогает, ведь Na+ соответствует сильному NaOH, который в воде распадается необратимо.
Такой процесс называется гидролизом по аниону. Анион забирает из воды гидроксид-анионы.
Получается, что при диссоциации соли среда меняется не потому, что появились новые Н+ или ОН–. Наоборот – исчезли те, которые УЖЕ были в воде. Вот поэтому нейтральная среда, где частиц одинаково, превратилась в щелочную с избытком ОН–. Такое происходит, когда соль соответствует сильному основанию, но слабой кислоте.
А наоборот бывает?
Естественно! Возьмём, скажем, хлорид магния MgCl2. Образован сильной кислотой HCl и слабым основанием Mg(OH)2.
Диссоциация:
MgCl2 ⇌ Mg2+ + 2 Cl–
Cl– не станет связываться с Н+ .В этом просто нет смысла – соляная кислота мгновенно сразу же распадается.
Но вот Mg2+станет объединяться с ОН– в растворе. Ведь Mg(OH)2 – слабое основание:
Mg2+ + OH– ⇌ MgOH+
Такой процесс называется гидролизом по катиону.
Таким образом здесь у нас начинает возникать недостаток ОН– . Соответственно становится слишком много Н+. Среда автоматически становится кислой. Это происходит, если соль образована слабым основанием и сильной кислотой.
А бывает такое, что соль всё же оставляет нейтральную среду?
Конечно. Самый очевидный случай – это если, соль образована и сильным основанием, и сильной кислотой, то из раствора не станут пропадать ни Н +, ни ОН–. Значит, и среда не поменяется.
Хорошо. Так а pH-то тут каким боком?
Тут всё просто. pH – это водородный показатель среды, или же показатель кислотности. Это всего-навсего перевод характера среды в числа.
По сути, надо знать три пункта:
Откуда именно такие цифры?
А вот это уже более сложная программа, и в школе редко проходится. Не стоит пока что забивать этим голову)
Почему это важно в жизни?
Как я уже говорил, pH – это буквально одно из главных условий жизни. Для некоторых систем, особенно для биосистем крайне важно поддерживать постоянную кислотность. В противном случае может произойти грустное.
Фан-факты:
Значит, электролит? Слабый, но да.
Протоны раствору даёт? Значит, кислота.
А гидроксид-анионы? Значит, основание.
И ведь неслучайно это важно. В какой-то момент людям стало понятно, что для успешного культивирования растений, аккуратной медицины, да даже для изготовления новых материалов важна такая штука, как «среда раствора», в котором и происходит всё это действо.
Известно, что выделяют три типа среды раствора:
- Кислая
- Нейтральная
- Щелочная
Очевидно, что в подкисленном растворе может наблюдаться избыток H+, а в щелочном растворе будет больше OH–. В нейтральном же и того, и другого одинаковое количество, и они то и дело объединяются обратно в воду.
То есть нейтральный раствор = водный.
Ну, допустим, всё понятно. Залил кислоту в раствор – и среда кислая. Чем сильнее кислота, тем более кислая среда. Растворил щёлочь – получил щелочную среду.
Но тогда, скажите на милость, каким образом при растворении нормальных, самых обычных солей меняется среда? Вот возьму, например, нитрит натрия NaNO2. Да, он электролит, и диссоциирует по следующей схеме:
NaNO2 ⇌ Na+ + NO2–
Ни тебе протонов, ни гидроксид-анионов. Макаю индикаторную бумажку – а она окрашивается так, будто среда щелочная. КАК?!
Спокойно, сейчас разберёмся.
Для начала вспомним, что соли всегда соответствуют каким-то кислотам и основаниям. Наш нитрит натрия – это продукт гидроксида натрия, от которого взят катион, и азотистой кислоты, от которой взят анион.
Вся фишка в том, что азотистая кислота сама по себе – слабая. То есть оказываясь в растворе, она диссоциирует (распадается) обратимо! Одновременно идёт и распад одних молекул, и образование новых.
HNO2 ⇌ H+ + NO2–
Но кто мне мешает переписать это уравнение задом наперёд? Смысл от этого не меняется.
H+ + NO2– ⇌ HNO2
Уже догадались, к чему я клоню?)0)
Мы бросили в раствор соль нитрит натрия. В воде всегда есть небольшое количество и катионов водорода H+, и гидроксид-анионов OH–. Фишка в том, что как только соль распалась на ионы, эти самые нитрит-анионы NO2– сразу же стали забирать H+. Ведь они соответствуют слабой кислоте HNO2.
А OH– никто не трогает, ведь Na+ соответствует сильному NaOH, который в воде распадается необратимо.
Такой процесс называется гидролизом по аниону. Анион забирает из воды гидроксид-анионы.
Получается, что при диссоциации соли среда меняется не потому, что появились новые Н+ или ОН–. Наоборот – исчезли те, которые УЖЕ были в воде. Вот поэтому нейтральная среда, где частиц одинаково, превратилась в щелочную с избытком ОН–. Такое происходит, когда соль соответствует сильному основанию, но слабой кислоте.
А наоборот бывает?
Естественно! Возьмём, скажем, хлорид магния MgCl2. Образован сильной кислотой HCl и слабым основанием Mg(OH)2.
Диссоциация:
MgCl2 ⇌ Mg2+ + 2 Cl–
Cl– не станет связываться с Н+ .В этом просто нет смысла – соляная кислота мгновенно сразу же распадается.
Но вот Mg2+станет объединяться с ОН– в растворе. Ведь Mg(OH)2 – слабое основание:
Mg2+ + OH– ⇌ MgOH+
Такой процесс называется гидролизом по катиону.
Таким образом здесь у нас начинает возникать недостаток ОН– . Соответственно становится слишком много Н+. Среда автоматически становится кислой. Это происходит, если соль образована слабым основанием и сильной кислотой.
А бывает такое, что соль всё же оставляет нейтральную среду?
Конечно. Самый очевидный случай – это если, соль образована и сильным основанием, и сильной кислотой, то из раствора не станут пропадать ни Н +, ни ОН–. Значит, и среда не поменяется.
Хорошо. Так а pH-то тут каким боком?
Тут всё просто. pH – это водородный показатель среды, или же показатель кислотности. Это всего-навсего перевод характера среды в числа.
По сути, надо знать три пункта:
- 7 – это нейтральная среда
- Всё, что меньше 7 – это кислая среда
- Всё, что больше 7 – это щелочная среда
Откуда именно такие цифры?
А вот это уже более сложная программа, и в школе редко проходится. Не стоит пока что забивать этим голову)
Почему это важно в жизни?
Как я уже говорил, pH – это буквально одно из главных условий жизни. Для некоторых систем, особенно для биосистем крайне важно поддерживать постоянную кислотность. В противном случае может произойти грустное.
Фан-факты:
- pH может быть нулевым, и даже отрицательным.
- Существует и обратная шкала – pOH, но ею пользуются намного реже. Её смысл ровно такой же, только всё что меньше 7 – там соответствует щелочной среде, а всё, что больше 7 – кислой.
- Показателем pH пользуются не только в химии, но и в биологии, медицине, агрономии.